提供元:CareNet.com

手術不能な局所再発または転移・再発トリプルネガティブ(TN)乳がんの1次治療においてペムブロリズマブ+化学療法をプラセボ+化学療法と比較した第III相KEYNOTE-355試験の探索的解析の結果、ペムブロリズマブ+化学療法により臨床的有用性が得られた患者でペムブロリズマブの最終投与前に化学療法を中止した患者、また免疫介在性有害事象(imAE)発現患者において、CPSにかかわらず、無増悪生存期間(PFS)および全生存期間(OS)が改善したことが示された。米国・UCSF Helen Diller Family Comprehensive Cancer Center のHope S. Rugo氏が欧州臨床腫瘍学会乳がん(ESMO Breast Cancer 2023、5月11~13日)で報告した。
本試験では、PD-L1 CPS 10以上の患者において、ペムブロリズマブ+化学療法により統計学的に有意かつ臨床的に意味のあるPFSとOSの改善が示されたことが報告されている。今回は、ペムブロリズマブ+化学療法を受け完全奏効(CR)もしくは部分奏効(PR)を達成または病勢安定(SD)を24週以上持続した患者、すなわち臨床的有用性が得られた患者のうちペムブロリズマブ最終投与前21日より前に化学療法を中止した患者におけるPFSとOSを評価した。さらに、ペムブロリズマブ+化学療法を受けた患者でimAEが1件以上発現した患者においても評価した。
・対象:PD-L1陽性の手術不能な局所再発もしくは転移・再発TN乳がん(ECOG PS 0/1)
・試験群:ペムブロリズマブ(200mg、3週ごと)+化学療法(ナブパクリタキセル、パクリタキセル、ゲムシタビン/カルボプラチンのうちいずれか)
・対照群:プラセボ+化学療法
今回の探索的解析における主な結果は以下のとおり。
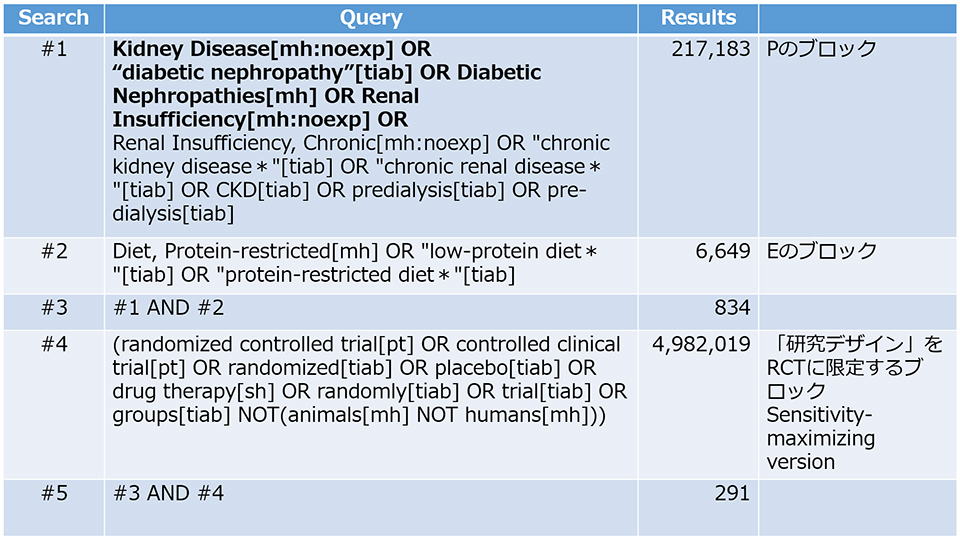
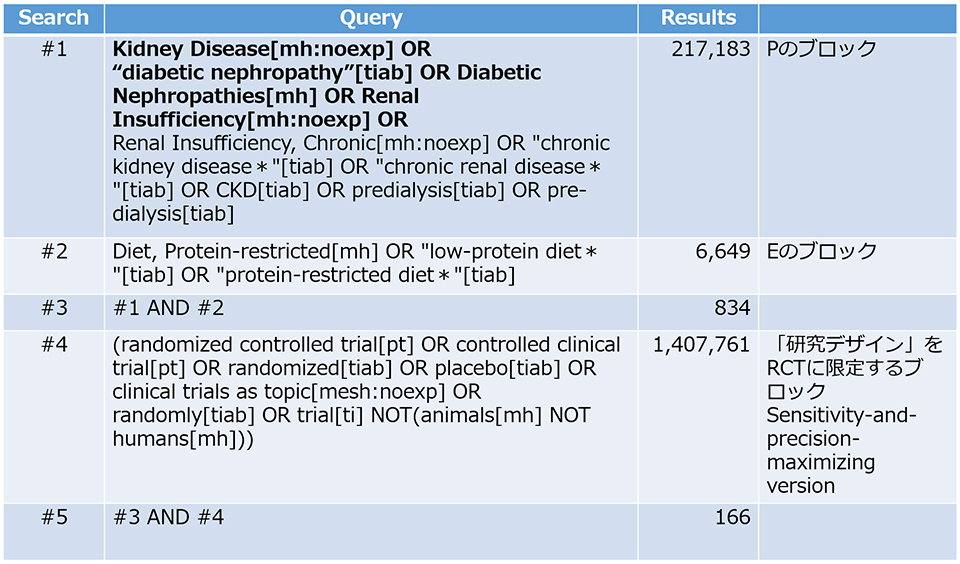
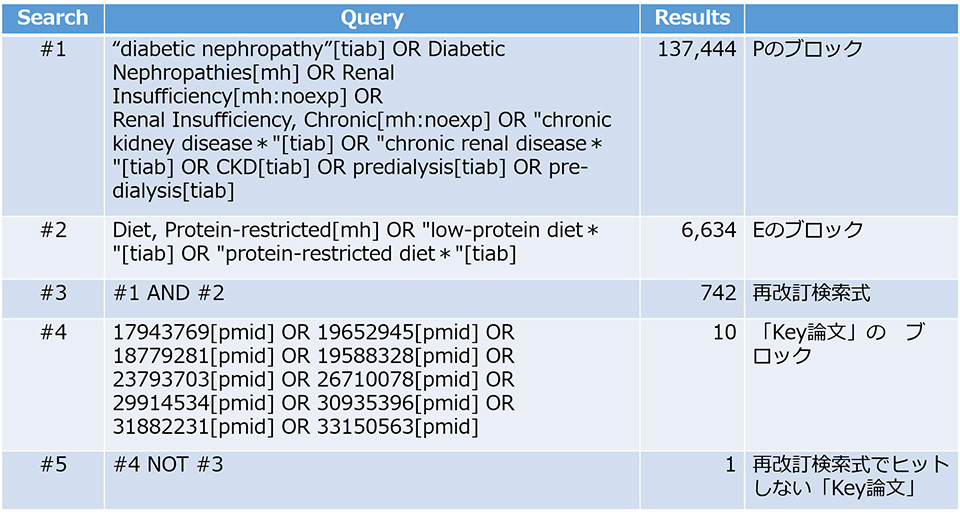
・2021年6月15日のデータカットオフ時点で、ペムブロリズマブ+化学療法の治療を受け臨床的有用性が得られた患者において、ペムブロリズマブ投与中止前に化学療法を中止した患者および全体でのペムブロリズマブ投与期間中央値、化学療法期間中央値、PFS中央値、OS中央値は、順に以下のとおりで、CPSに関係なくPFS、OSとも上回っていた。
– 治療を受けた全患者
化学療法中止例(92例):14.1ヵ月 6.0ヵ月 14.5ヵ月 32.9ヵ月
全体(317例) : 9.4ヵ月 7.9ヵ月 11.6ヵ月 26.4ヵ月
– CPS 1以上の患者
化学療法中止例(70例):15.3ヵ月 5.9ヵ月 18.7ヵ月 34.5ヵ月
全体(249例) : 9.4ヵ月 8.2ヵ月 11.7ヵ月 26.6ヵ月
– CPS 10以上の患者
化学療法中止例(46例):20.8ヵ月 6.8ヵ月 36.7ヵ月 未到達
全体(143例) :11.1ヵ月 8.5ヵ月 14.4ヵ月 34.4ヵ月
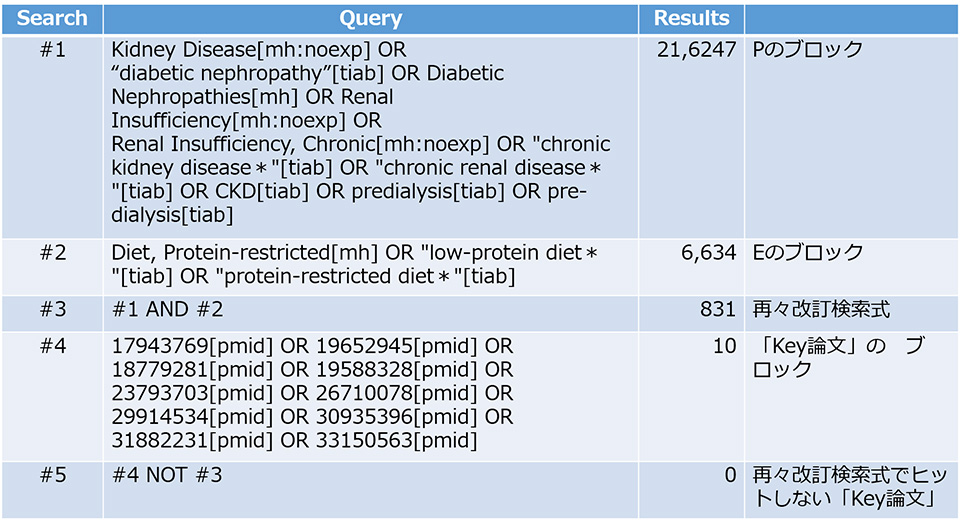
・imAE発現患者および全体におけるペムブロリズマブ投与期間中央値、化学療法期間中央値、PFS中央値、OS中央値は、順に以下のとおりで、imAE発現患者でPFS、OSとも上回っていた。
– 治療を受けた全患者
imAE発現例(149例):8.8ヵ月 7.2ヵ月 9.7ヵ月 23.9ヵ月
全体(562例) :5.6ヵ月 5.1ヵ月 7.5ヵ月 17.2ヵ月
– CPS 1以上の患者
imAE発現例(109例):8.8ヵ月 7.3ヵ月 9.8ヵ月 26.3ヵ月
全体(421例) :5.9ヵ月 5.1ヵ月 7.6ヵ月 17.6ヵ月
– CPS 10以上の患者
imAE発現例(64例):10.4ヵ月 8.4ヵ月 11.8ヵ月 35.6ヵ月
全体(219例) : 7.6ヵ月 5.8ヵ月 9.7ヵ月 22.8ヵ月
今回の解析から、ペムブロリズマブ+化学療法で臨床的有用性が得られた患者において、PD-L1発現レベルにかかわらず、化学療法中止後もペムブロリズマブは有用であることが示唆された。この結果から、Rugo氏は「臨床的有用性が得られて化学療法を中止した患者において、ペムブロリズマブ継続が適している」とした。
(ケアネット 金沢 浩子)
【参考文献・参考サイトはこちら】